
เมื่อละอองน้ำมันที่ร่วงผ่านรูบนขั้วไฟฟ้าบวกกระทบรังสีจะมีประจุไฟฟ้าเกิดขึ้น ทำให้ละอองน้ำมันบางหยดเคลื่อนที่เข้าหาขั้วไฟฟ้าบวก บางหยดเคลื่อนที่เข้าหาขั้วไฟฟ้าลบ และบางหยดลอยนิ่งอยู่ระหว่างสนามไฟฟ้า และจากความสัมพันธ์ของน้ำหนักของหยดน้ำมันที่ลอยนิ่งเท่ากับแรงที่เกิดจากสนามไฟฟ้า ทำให้สามารถคำนวนค่าประจุไฟฟ้าบนหยดน้ำมันได้ ซึ่งพบว่าประจุไฟฟ้าบนหยดน้ำมันมีค่าเป็นจำนวนเท่าของ1.6 x 10–19 คูลอมบ์ เมื่อนำมาคำนวนร่วมกับค่าประจุต่อมวลที่รายงานไว้โดยทอมสันจะได้มวลของอิเล็กตรอนเท่ากับ9.11 X 10-28 กรัม
ในปีพ.ศ.2429 ออยเกน โกลด์ชไตน์ ได้ทำการดัดแปลงหลอดรังสีแคโทดโดยการสลับตำแหน่งของแคโทดและแอโนด ดังรูป

ซึ่งเมื่อผ่านกระแสไฟฟ้าเข้าไปพบว่า ฉากเกิดการเรืองแสง แสดงว่ามีรังสีออกจากแอโนด ซึ่งโกลด์ชไตน์เรียกรังสีชนิดนี้ว่า รังสีแคแนล หรือรังสีแอโนด ซึ่งมีประจุบวก โกลด์ชไตน์ได้ทำการทดลองกับแก๊สหลายชนิดพบว่ารังสีแอโนดมีค่าประจุต่อมวล (e/m)ไม่คงที่ จนกระทั่งกลุ่มนักวิจัยนำทีมโดยรัทเทอร์ฟอร์ดและทอมสันได้ทำการศึกษาหลอดในลักษณะเดียวกันที่บรรจุแก๊สไฮโดรเจน ทำให้ได้ข้อสรุปว่าอนุภาคบวกมีค่าประจุเท่ากันกับอิเล็กตรอน และหาค่ามวลของประจุบวกได้เป็น1.66 x 10-24 กรัม ซึ่งมากกว่ามวลของอิเล็กตรอนประมาณ1840 เท่า เรียกอนุภาคนี้ว่า โปรตอน
ในปี พ.ศ. 2475 เจมส์ แชดวิก นักวิทยาศาสตร์ชาวอังกฤษได้ทดลองยิงอนุภาคแอลฟาไปยังอะตอมของธาตุต่างๆและทดสอบผลการทดลองด้วยเครื่องมือที่มีความเที่ยงสูง ทำให้ทราบว่าในนิวเคลียสมีอนุภาคที่เป็นกลางทางไฟฟ้าและเรียกอนุภาคนี้ว่า นิวตรอนซึ่งมีมวลใกล้เคียงกับมวลของโปรตอน การค้นพบนิวตรอนช่วยอธิบายและสนับสนุนข้อมูลเกี่ยวกับมวลของอะตอม ซึ่งพบว่ามีค่ามากกว่ามวลรวมของโปรตอน เช่น ธาตุคาร์บอนมีมวลของโปรตอนรวมกัน 6 หน่วย แต่มวลของอะตอมมีค่า 12 หน่วย และมวลของธาตุส่วนใหญ่มีค่าเป็น 2 เท่าหรือมากกว่า 2 เท่าของมวลโปรตอนทั้งหมดรวมกัน ดังนั้น อิเล็กตรอน โปรตอน และนิวตรอน จึงเป็น อนุภาคในอะตอม ซึ่งอนุภาคแต่ละชนิดมีรายละเอียด ดังนี้
 ง
งเลขอะตอม เลขมวล และ ไอโซโทป
อะตอมประกอบด้วยโปรตอนและนิวตรอนรวมกันเป็นนิวเคลียสของอะตอม และมีอิเล็กตรอนซึ่งมีจำนวนเท่ากับจำนวนโปรตอนเคลื่อนที่อยู่รอบนิวเคลียส อะตอมของธาตุแต่ละชนิดมีจำนวนโปรตอนเฉพาะตัวไม่ซ้ำกับธาตุอื่น ตัวเลขที่แสดงจำนวนโปรตอนเรียกว่า เลขอะตอม และเนื่องจากมวลของอิเล็กตรอนมีค่าน้อยมาก ดังนั้นมวลของอะตอมส่วนใหญ่จึงเป็นมวลของนิวเคลียสที่ประกอบด้วยโปรตอนและนิวตรอน เรียกผลรวมของจำนวนโปรตอนและนิวตรอนว่า เลขมวล เช่น คาร์บอนมี 6 โปรตอนจึงมีเลขอะตอมเท่ากับ 6 โดยอาจมี 6 หรือ 7 นิวตรอน จึงมีเลขมวลเป็น 12 หรือ 13 ตามลำดับ
สัญลักษณ์ที่เขียนแสดงรายละเอียดเกี่ยวกับสัญลักษณ์ของธาตุ เลขอะตอม และเลขมวลของอะตอม เรียกว่า สัญลักษณ์นิวเคลียร์ วิธีเขียนที่ตกลงกันเป็นสากล ให้เขียนเลขอะตอมไว้ด้านล่างซ้าย และเลขมวลไว้ด้านบนซ้ายของสัญลักษณ์

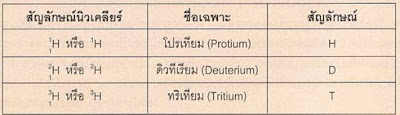
อะตอมของธาตุชนิดเดียวกันมีจำนวนโปรตอนและอิเล็กตรอนเท่ากัน แต่จำนวนนิวตรอนอาจมีได้หลายค่า ทำให้อะตอมของธาตุเดียวกันมีมวลต่างกัน เฟรเดอริก ซอดดี นักเคมีชาวอังกฤษ เรียกอะตอมของธาตุเดียวกันที่มีเลขมวลต่างกันว่า ไอโซโทป ธาตุชนิดหนึ่งอาจมีหลายไอโซโทป บางไอโซโทปมีอยู่ในธรรมชาติและบางไอโซโทปได้จากการสังเคราะห์ เช่น ไฮโดรเจน มี 3 ไอโซโทป มีเลขมวล 1 2 และ 3 มีชื่อเฉพาะว่า โปรเทียม ดิวทีเรียม และทริเทียม ตามลำดับ ไฮโดรเจนที่เกิดในธรรมชาติมีปริมาณโปรเทียมอยู่ถึงร้อยละ 99.99 แต่ละไอโซโทปของไฮโดรเจนมีชื่อเฉพาะและใช้สัญลักษณ์แทนดังตาราง

ไม่มีความคิดเห็น:
แสดงความคิดเห็น